La nomenclatura química es un conjunto de reglas o fórmulas que se utilizan para nombrar todos los elementos y los compuestos químicos. Actualmente la IUPAC (Unión Internacional de Química Pura y Aplicada, en inglés (International Union of Pure and Applied Chemistry) es la máxima autoridad en materia de nomenclatura química, la cual se encarga de establecer las reglas correspondientes.
La química orgánica y la inorgánica se separan a la hora de estudiar a profundidad sus propiedades debido a que los científicos se dieron cuenta de la gran variedad de compuestos que puede formar el carbono por sí solo en comparación con el resto de los elementos químicos. Además de que la evidencia experimental mostraba que muchos de ellos eran parte constituyente de los seres vivos. La química orgánica estudia el comportamiento de los compuestos covalentes de carbono caracterizados por su elevado peso molecular. (ejemplos, hidrocarburos, compuestos aromáticos, biomoléculas como carbohidratos, proteínas, lípidos, etc.). Son sustancias que se pueden encontrar en formas vivientes.
La química inorgánica estudia el comportamiento del resto de elementos químicos y algunos compuestos de carbono que forman estructuras no encontradas en los seres vivos (carburos, grafito, carbón de hulla , diamantes, fullerenos etc.)
A continuación abordaremos la información necesaria para poder nomenclar los compuestos orgánicos:
Existen varias maneras de nomenclar dichos compuestos, pero en esta ocasión nos enfocaremos en la mas usada y eficiente, establecida por la Unión Internacional de Química Pura y Aplicada (IUPAC).
HIDROCARBUROS:
Listo, ahora que que sabemos lo que es nomenclar, comenzaremos desde la parte más simple, y de la que se desglosan las partes mas complejas. Los hidrocarburos están formados únicamente por átomos de carbono e hidrógeno. El carbono tiene unas características muy particulares, únicas entre los demás elementos, es capaz de formar largas cadenas con átomos del mismo tipo o diferentes, ademas de que presenta diversas formas alotrópicas, como el carbón, y el diamante. lo que lo hace merecedor de una categoría a parte, como ya habíamos hablado en un principio, y por consiguiente, una manera de nomenclar los compuestos orgánicos.
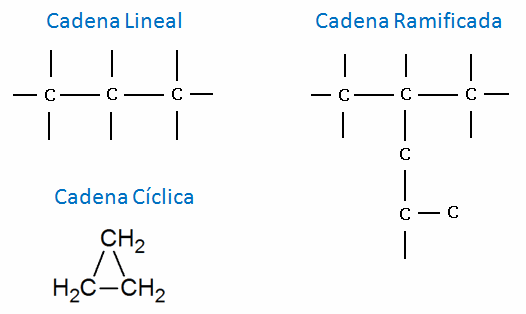
Las cadenas carbonadas pueden representarse de dos maneras:
Los carbonos de los compuestos orgánicos en su forma normal siempre tienen 4 enlaces, siendo a átomos de hidrógeno como se ve en la imagen, o a otros elementos como veremos mas adelante. en la parte izquierda se ve una representación de la cadena con los carbonos enlazados y sus respectivos átomos de hidrógeno, y a la derecha vemos una representación mas simple, sabiendo que cada extremo corresponde a un átomo de carbono, y se infiere entonces que cada uno de los carbonos tiene sus respectivos hidrógenos para completar los enlaces del carbono.
Para nombrar estas cadenas es necesario saber los prefijos que se utilizan para nombrar las cadenas, según el numero de carbonos que éstas tienen. Como nos muestra la siguiente imagen:

Entonces:
Como podemos observar, en la imagen hay solamente 1 carbono, con sus respectivos hidrógenos enlazados, lo que según la tabla corresponde al METANO.
ALCANOS
Los alcanos corresponden a los hidrocarburos que tienen dentro de su molécula solamente enlaces simples, como el ejemplo anterior. estos se nombran utilizando el sufijo -ANO.
ALQUENOS
Estos corresponden a los hidrocarburos que tienen enlaces dobles dentro de su molécula. Se nombran utilizando el sufijo -ENO. y se comienzan a nombrar desde el extremo mas cercano al doble enlace.

Esta imagen corresponde al PROPENO, conforme a la tabla, pues tiene 3 carbonos dentro de su molécula, y la terminación -ENO, corresponde a su doble enlace, que lo convierte en un alqueno, se comienza a nombrar de derecha a izquierda, por la cercania a su doble enlace.Como ya sabíamos el carbono puede formar solamente 4 enlaces, por lo que el doble enlace con otro carbono hace que no pueda enlazarse con otro hidrógeno. En este casi el doble enlace está en un carbono en el extremo, por lo que no es necesario colocar su ubicación, cuando no es así, hacemos lo siguiente:

En esta ocasión podemos observar que el doble enlace se encuentra en uno de los carbonos intermedios, por lo que es necesarios señalar su ubicación. Comenzamos entonces por el carbono que esté mas cerca del doble enlace. por lo que la imagen corresponde al 2-PENTENO.
ALQUINOS
Los alquinos son hidrocarburos que tienen enlaces triples dentro de su molécula, para nombrarlos se coloca el sufijo -INO, y si es necesario, se indica la posición del doble enlace como en el numeral anterior.
Tenemos una molécula con 2 carbonos, y un triple enlace, lo que significa que es un ETINO.
Algunos ejemplos:

Algunos ejemplos:
NOTA: A los hidrocarburos que tienen solo enlaces simples, se les llama SATURADOS, debido a que sus carbonos están enlazados a muchos hidrógenos. A los que tienen enlaces dobles y triples, se les llama INSATURADOS, debido a que por sus enlaces entre carbono, hace que tengan menos hidrógenos enlazados a ellos.
 CICLOBUTANO
CICLOBUTANO
HIDROCARBUROS CÍCLICOS.
son hidrocarburos saturados, que comparten de manera ciclica enlaces carbono-carbono. Se nombran con el prefijo CICLO.
Tambien pueden representarse de manera sencilla, donde cada esquina corresponde a un carbono.

cuando dentro del ciclo encontramos dobles enlaces colocamos normalmente el prefijo -CICLO y el sufijo -ENO ó -INO respectivamente, y se indica su posición si es necesario.
como vemos en el ejemplo anterior indicamos la posición de los dobles enlaces, y si existen mas de uno, lo nombramos con los prefijos comunes DI, TRI, TETRA, PENTA, HEXA, etc. 1,2-ciclooctadieno.
RADICALES:
Son especies quimicas que pierden H unido a un C, posteriormente la inestabilidad de la molecula la hace unirse facilmente a una cadena carbonada. estos se nombran con los mismos prefijos anunciados anteriormente pero el sufijo cambia a -ILO
En la siguiente tabla se observan los primeros radicales de forma normal, que se unen a las moléculas por uno de sus extremos (izquierda) Y los que se unen a las moléculas por uno de sus carbonos intermedios (derecha)

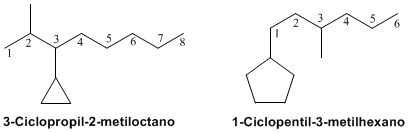
Para nombrar compuestos que tengan RAMIFICACIONES, es decir, radicales unidos a su cadena carbonada,
Comenzamos nombrando del lado mas ramificado o mas cercano a la ramificación, indicando la posición del radical, el radical, y posteriormente el nombre del compuesto, como observaremos a continuación:
Donde señalamos con color rojo la cadena mas larga, y en negro los radicales. Este ejemplo corresponde al 4-etil-2-metilheptano.
¿Por que colocamos primero el etil? por que esta nomenclatura se guarda un orden alfabético, es por eso que el ETIL se nombra antes que el METIL.
ALGUNOS EJEMPLOS:
5-isopropil-3-metilnonano.

Los enlaces dobles son mas importantes a la hora de nombrar, por lo que comenzamos a nombrar por la cadena mas cercana a éste.

Cuando tenemos una cadena muy larga como ramificación, recurrimos a nombrarla como si estuviera sola entre paréntesis, y a indicar su posición, como en la imagen anterior.
CON HIDROCARBUROS CÍCLICOS:
METILCICLOPENTANO
- Si el ciclo tiene varios sustituyentes se numeran de forma que reciban los localizadores más bajos, y se ordenan por orden alfabético. En caso de que haya varias opciones decidirá el orden de preferencia alfabético de los radicales.
1-etil-3-metil-5-propilciclohexano
En caso de encontrar ciclos en nuestra cadena carbonada, nombramos desde el extremo mas cercano al ciclo.
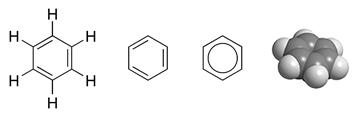
TODOS LOS EJEMPLOS TRABAJADOS HASTA ESTE PUNTO CORRESPONDEN A HIDROCARBUROS ALIFÁTICOS, AHORA HABLAREMOS DE LOS HIDROCARBUROS AROMÁTICOS, LOS CUALES TIENEN COMO BASE LA MOLÉCULA DE BENCENO.
TODOS LOS COMPUESTOS QUE CONTENGAN BENCENO, SON AROMÁTICOS.
ESTA MOLÉCULA TIENE LA CAPACIDAD DE RESONAR, ES DECIR, SUS DOBLES ENLACES ROTAN ENTRE SUS CARBONOS, LO QUE LOS HACE ÚNICOS.
para nombrarlos colocamos el sufijo del radical, y después la palabra benceno.
Cuando lo queremos nombrar como sustituyente en una cadena, colocamos la el prefijo -FENIL

a la acumulación de varios ciclos dentro de una molécula, se les llama POLICICLOS, y los mas conocidos con su nombre vulgar son:

todos estos compuestos son aromáticos.
Regla de Hückel
En química orgánica, la regla de Hückel relaciona la aromaticidad con el número de electrones deslocalizados en orbitales sp2 de una molécula orgánica plana y cíclica que tiene enlaces simples y enlaces dobles conjugados. En concreto, la regla de Hückel indica que una molécula plana es aromática si tiene 4n+2 electrones π, y antiaromática si tiene 4n electrones π. La importancia de la regla radica en la gran diferencia de estabilidad entre compuestos aromáticos, no aromáticos y antiaromáticos, de forma que se pueden hacer predicciones cualitativas sobre la estabilidad química de los diferentes compuestos de forma sencilla. En concreto se puede aplicar la regla de Hückel del siguiente modo: 4n+2 debe ser igual al número de electrones π ( número de dobles enlaces x 2), si el número de electrones π es igual a "4n", será antiaromático. Si no cumple las reglas es no aromático.

GRUPOS FUNCIONALES
La química orgánica se puede decir que es el primer paso para la vida, son muchos los procesos químicos que se realizan para que la vida sea posible y hoy hablaremos de los grupos funcionales que participan de forma activa y directa en las reacciones químicas a nivel celular, las cuales permiten que se pueda dar la vida.
Un grupo funcional es un átomo o conjunto de átomos que forman moléculas, las cuales confieren características específicas a las cadenas hidrocarbonadas, todas aquellas moléculas que presentan un mismo grupo funcional actúan de manera similar.
Estos grupos se diferencian entre sí por los átomos que conforman estas moléculas y son responsables de la reactividad y propiedades químicas de los compuestos orgánicos.
La combinación de los nombres de los grupos funcionales con los nombres de los alcanos dan una forma de denominar y agrupar los compuestos orgánicos, por ejemplo a través de las reglas de nomenclatura sustitutiva que es el sistema más recomendado por la IUPAC, éste consiste en aplicar los siguientes parámetros:
1. Cuando haya un único grupo funcional en el compuesto, la cadena principal debe contenerlo, aunque resulte más corta que otras.
2. La cadena principal se nombra de tal manera que el grupo funcional tenga el localizador de cadena más bajo posible y para ello se utilizará un determinado –sufijo.
Para tener en cuenta:
· Al momento de enumerar el grupo funcional tiene prioridad sobre las insaturaciones) o sobre cualquier radical de hidrocarburo, con excepción de los derivados halogenados y los nitrocompuestos; en estos dos casos, la prioridad se invierte y se asignan los localizadores más bajos a las insaturaciones.
Al presentarse más de un grupo funcional en la cadena, lo primero que debemos hacer es escoger uno de ellos como el principal, dependiendo de la prioridad que tenga según la tabla de orden de preferencia de los grupos funcionales, y para el cual a la hora de nombrarlo se utilizará un determinado –sufijo y en el caso del resto de los grupos funcionales, estos serán tomados en cuenta como sustituyentes y se nombraran utilizando un determinado -prefijo
Hay otra forma de nombrar los compuestos, aunque no tan común y es a través de la nomenclatura radicofuncional:
La cual nos dice que a la hora de nombrar el compuesto, éste se forma de dos palabras: una que indica el tipo de grupo funcional y la otra que indica el nombre de el, o los radicales
Orden de preferencia de los grupos funcionales: (un grupo funcional tiene más prioridad cuanto más arriba esté en la tabla)
En esta ocasión estudiaremos 14grupos funcionales, aprenderemos características generales, su definición, como se nombra cada uno de ellos y ejemplos para que se haga mas fácil su aprendizaje.
NITRODERIVADOS
¿Qué son?
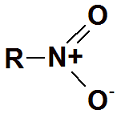
Los nitroderivados (o nitrocompuestos o compuestos nitro) son compuestos orgánicos que contienen uno o más grupos funcionales nitro (-NO2). Son a menudo altamente explosivos; impurezas varias o una manipulación inapropiada pueden fácilmente desencadenar una descomposición exotérmica violenta.
Cuando el Grupo Nitro se une a un Hidrocarburo cualquiera (R) da lugar a un Nitroderivados o Nitrocompuesto:
Si el Grupo Nitro se une a una cadena de Hidrocarburo Alifático da lugar a los Nitroderivados Alifáticos. Si lo hace con un derivado del benceno da lugar a los Nitroderivados Aromáticos.
Propiedades:
El Grupo Nitro confiere a los Nitroderivados o Nitrocompuestos las siguientes características:
· Son altamente explosivos
Algunos ejemplos de nitrocompuestos o nitroderivados:
CH3-NO2 ----> nitrometano
CH3-CHNO2-CH2-CH3 ----> 2-nitrobutano
CH2 = CH-CH2-NO2 ----> 3-nitro-1-propeno
CH3-CH = CH-CH2-CH2-NO2 ----> 5-nitro-2-penteno
CH3-CH2-CH2-CH2-NO2 ---->nitrobutano
¿Cómo se nombra?
- Se nombran como sustituyentes del hidrocarburo del que proceden indicando con el prefijo "nitro-" y un número localizador su posición en la cadena carbonada.
2-nitrobutano
|
- Las insaturaciones tienen preferencia sobre el grupo nitro.
3-nitro-1-propeno
|
DERIVADOS HALOGENADOS
¿Qué son?
Son derivados de los hidrocarburos en los que se sustituye uno o varios átomos de hidrógeno por uno o varios átomos de halógenos (F, Cl, I, Br, At) estos se nombran a veces como haluros de alquilo
Estructura:
Formula general de los derivados halogenados
R-X: Donde R es el radical y X es Flúor (F), Cloro (Cl), Bromo (Br) y Yodo (I)
Características:
Estos compuestos tienen una alta densidad. Comúnmente son utilizados como refrigerantes, disolventes, pesticidas, repelentes de polillas, también son utilizados como componentes en algunos plásticos, entre otras utilizaciones a nivel industrial y biológicos.
Clasificación
Pueden clasificarse como primarios secundarios o terciarios, según la naturaleza del átomo de carbono al que va unido el átomo de halógeno.
¿Cómo se nombran?
Se nombran, citando en primer lugar el halógeno (flúor, cloro, bromo, yodo) seguido del nombre del hidrocarburo, si es necesario se cita la posición que ocupa el halógeno en la cadena, teniendo en cuenta que los dobles y triples enlaces tienen prioridad sobre el halógeno, en cuanto a la asignación de los números se enumera de tal manera que a las insaturaciones le correspondan los localizadores más bajos
· Para nombrar derivados halogenados de cadena ramificada, los halógenos se consideran radicales y debemos citarlos por orden alfabético.
· En caso de aparecer el mismo halogeno repetido, se utilizan los prefijos tales como: di, tri, tetra, etc. Dependiendo del numero de halogenos que aparezcan, y anterior a él especificamente en lugar donde estan ubicados.
ALQUINOS
¿Qué son?
Los Alquinos (también llamados Hidrocarburos Acetilénicos) son compuestos orgánicos del grupo de los Hidrocarburos, es decir, que están formados únicamente por átomos de carbono e hidrógeno.
Lo que diferencia a los Alquinos del resto de Hidrocarburos es que sus átomos de carbono están unidos por al menos un enlace triple (-C≡C-).
Lo que diferencia a los Alquinos del resto de Hidrocarburos es que sus átomos de carbono están unidos por al menos un enlace triple (-C≡C-).
La Fórmula Molecular de los Alquinos es CnH2n-2, por ejemplo el etino (CH≡CH) tiene fórmula molecular C2H2 y la del propino (CH3-C≡CH) es C3H4.
¿Cómo se nombra?
1. Los Alquinos se nombran añadiendo la terminación "-ino"
etino
propino
2. La posición del triple enlace se indica mediante un localizador procurando que el número sea el más bajo posible:
CH3-CH2-C≡CH → 1-butino
CH3-C≡C-CH3 → 2-butino
CH3-CH2-C≡C-CH3 → 2-pentino
3. Si existen varios triples enlaces se indica añadiendo un prefijo (di, tri, tetra...):
CH≡C-CH2-CH2-CH2-CH3 1-hexino
CH≡C-C≡C-CH2-CH3 1, 3-hexadiino
CH≡C-C≡C-C≡CH 1, 3, 5-hexatriino
4. Si existen enlaces dobles y triples se indica primero el doble con el localizador lo más bajo posible :
o CH=CH-C≡CH 1-buten-3-ino
o CH≡C-CH=CH-CH=CH2 1,3-hexadien-5-ino
o CH≡C-CH2-CH=CH2 1-penten-4-ino
5. Si la molécula es ramificada se tomará como cadena principal la más larga que contenga los triples o dobles enlaces
6. Los radicales de los Alquinos se nombran de igual manera pero con la terminación "-inilo":
CH≡C- etinilo
CH3-C≡C- 1-propinilo
HC≡C-CH2- 2-propinilo
ALQUENOS
¿Qué son?
Los alquenos son hidrocarburos que contienen enlaces dobles carbono-carbono. Se emplea frecuentemente la palabra olefina como sinónimo.
Los alquenos abundan en la naturaleza. El eteno, es un compuesto que controla el crecimiento de las plantas, la germinación de las semillas y la maduración de los frutos.
Los alquenos abundan en la naturaleza. El eteno, es un compuesto que controla el crecimiento de las plantas, la germinación de las semillas y la maduración de los frutos.
Propiedades físicas:
son comparables a las de los alcanos. Los alquenos más sencillos eteno, propeno y buteno son gases, los alquenos de cinco átomos de carbono hasta quince son líquidos y los alquenos con más de quince átomos de carbono son sólidos.
Los puntos de fusión de los alquenos se incrementan al aumentar el tamaño de la cadena.
La densidad de los alquenos es menor a la del agua y solamente son solubles en solventes no polares.
La densidad de los alquenos es menor a la del agua y solamente son solubles en solventes no polares.
Propiedades químicas:
- Los alquenos son más reactivos que los alcanos debido a la presencia del doble enlace
-Los alquenos, como los alcanos son altamente combustibles y reaccionan con el oxigeno formando como productos dióxido de carbono, agua y energía en forma de calor.
-Son generalmente compuestos débilmente polares, su polaridad es ligeramente superior a la de los alcanos.
¿Cómo se nombra?
Se nombran igual que los alcanos, pero con la terminación en "-eno". De todas formas, hay que seguir las siguientes reglas:
- Se escoge como cadena principal la más larga que contenga el doble enlace. De haber ramificaciones se toma como cadena principal la que contenga el mayor número de dobles enlaces, Aunque sea más corta que las otras.
- Se comienza a contar por el extremo más cercano a un doble enlace, con lo que el doble enlace tiene preferencia sobre las cadenas laterales a la hora de nombrar los carbonos,y se nombra el hidrocarburo especificando el primer carbono que contiene ese doble enlace.
4-metil-1-penteno o 4-metilpent-1-eno*
|
· Según las normas de 1993 la IUPAC recomienda la colocación del número localizador inmediatamente antes del sufijo, aunque multitud de revistas científicas usan el sistema anterior. En esta web usaré indistintamente los dos sistemas.
- En el caso de que hubiera más de un doble enlace se emplean las terminaciones, "-dieno", "-trieno", etc., precedidas por los números que indican la posición de esos dobles enlaces.
1,3,5-hexatrieno o hexa-1,3,5-trieno
|
ÉTERES
¿Qué son?
Son compuestos que resultan de la unión de dos radicales alquílicos o aromáticos a través de un puente de Oxigeno –O-.
Según el tipo de radicales, los éteres pueden ser:
Alifaticos R—O—R’: dónde R y R' pueden ser grupos idénticos o diferentes y pueden ser grupos alquilo o arilo.
Aromáticos Ar—O—Ar: los dos radicales arílicos
Mixtos R—O—Ar: un radical alquilo y otro arilico
Características
La mayoría de éteres son líquidos volátiles, ligeros e inflamables, solubles en alcoholes y otros disolventes orgánicos. Des el punto de vista químico son inertes y estables
¿Cómo se nombran?
- A la hora de nombrar los éteres hay dos alternativas:
Los éteres al nombrarse como alcoxi derivados de alcanos a través de la nomenclatura IUPAC sustitutiva, primero tomamos como cadena principal la de mayor longitud a partir del –O– y se nombra el alcóxido como el radical más sencillo y posteriormente el número de carbonos que tiene la cadena más larga terminando en ano.
La segunda es citar los dos radicales que están unidos al –O– por orden alfabético y a continuación la palabra éter
- Los éteres cíclicos se forman sustituyendo un -CH2- por -O- en un ciclo. La numeración comienza en el oxígeno y se nombran con el prefijo oxa- seguido del nombre del ciclo.
AMINAS
¿Qué son?
· Las aminas son derivados orgánicos del amoniaco, NH3 el que se han sustituido uno o más átomos de H por grupos orgánicos R, su clasificación se basa en el número de grupos unidos al átomo de nitrógeno uno para las aminas primarias, dos para las secundarias y tres para las terciarias. El nitrógeno del amoniaco puede considerarse híbrido sp3; la molécula es casi tetraédrica con hidrógenos en tres de los vértices y un par no compartido en el cuarto. El ángulo HNH es de 107 grados. Si el nitrógeno hubiera adoptado una geometría plana en la que los orbitales enlazantes fueran sp2 y el orbital p restante contuviera el par no compartido, la energía de la molécula seria mayor. La diferencia de energía entre la geometría piramidal y plana es solo de un 10% de la de un enlace químico normal.
Características
Según su estructura:
Las aminas pueden clasificarse de acuerdo con el número de grupos alquilo o arilo unidos al nitrógeno. RNH2 es una amina primaria, R2NH es una amina secundaria, R3N es una amina terciaria y ArNH2 es una amina aromática, como se muestra a continuación.
Propiedades físicas
Las aminas son compuestos incoloros que se oxidan con facilidad lo que permite que se encuentren como compuestos coloreados. Los primeros miembros de esta serie son gases con olor similar al amoniaco. A medida que aumenta el número de átomos de carbono de la molécula Las aminas aromáticas son muy toxicas se absorben a través de la piel.
· Solubilidad :
Las aminas primarias y secundarias son compuestos polares, capaces de formar puentes de hidrógeno entre sí y con el agua, esto las hace solubles en ella. La solubilidad disminuye en las moléculas con más de 6 átomos de carbono y en las que poseen el anillo aromático.
· Punto ebullición:
El punto de ebullición de las aminas es más alto que el de los compuestos apolares que presentan el mismo peso molecular de las aminas. El nitrógeno es menos electronegativo que el oxígeno, esto hace que los puentes de hidrógeno entre las aminas se den en menor grado que en los alcoholes. Esto hace que el punto de ebullición de las aminas sea más abajo que el de los alcoholes del mismo peso molecular.
· En general las propiedades de las aminas dependen del grado de sustitución sobre el nitrógeno, que determina la posibilidad de formar puentes de hidrógeno entre el o los hidrógenos del grupo -NH2 y un extremo de otra molécula, por ejemplo, el oxigeno del agua o el nitrógeno de otra amina.
· Las aminas terciarias han sustituido todos los hidrógenos por otros grupos, por lo que no pueden formar enlaces de hidrógeno y se comportan generalmente como moléculas generalmente apolares.
· Si bien los puentes de hidrógenos entre las aminas son menos fuertes que aquellos presentes entre compuestos oxigenados, estas fuerzas explican la solubilidad de las aminas de bajo peso molecular en agua y otros solventes polares.
· Las aminas, especialmente de bajo peso molecular, tienen olores fuertes y penetrantes, similares al amoniaco. Por ejemplo la trimetilamina presenta un olor característico a pescado.
· Propiedades químicas:
(Basicidad)
Las propiedades químicas de las aminas son semejantes a las del amoniaco. Al igual que éste, son sustancias básicas; son aceptores de protones, según la definición de Brønsted-Lowry.
Las aminas presentan reacciones de neutralización con los ácidos y forman sales de alquilamonio (también denominadas sales de amina). Por ejemplo la etilamina se combina con el ácido clorhídrico, para producir cloruro de etilamonio.
El cloruro de etilamonio es una sal de alquilamonio. Un grupo etilo y tres átomos de hidrógeno están unidos al átomo de nitrógeno en este compuesto. Si la dietilamina, (CH3CH2)2NH, se combina con el HBr se produce el brumuro de dietilamonio, una sal de dialquilamonio.
Un uso práctico para convertir las aminas a sus sales es el producir aminas de mayor masa molecular y soluble en agua. La mayoría de las aminas de gran masa molecular son insolubles en agua, pero después de combinarse con un ácido forman una sal de amina iónica soluble. Por ejemplo, la lidocaína, un anestésico local que es insoluble en agua como amina libre; después de combinarse con el HCl forma un clorhidrato de lidocaína el cual es soluble en agua.
La lidocaína es insoluble debido al carácter no polar de la molécula. Después de combinarse con el HCl se convierte en un compuesto iónico. Un gran porcentaje de los compuestos iónicos son solubles en agua.
Muchas de las aminas esenciales en los seres vivos existen como sales de aminas y no como aminas. Uno de estos compuestos es el neurotransmisor acetilcolina. La acetilcolina se libera en el extremo de un nervio, viaja a través de la brecha sináptica, se une a otro miembro y origina un impulso nervioso. Durante el tiempo en que la molécula de acetilcolina viaja a través de la brecha sináptica, su estructura es la siguiente:
|
¿Cómo se nombra?
Regla 1.
Las aminas se pueden nombrar como derivados de alquilaminas o alcanoaminas. Veamos algunos ejemplos.
Regla 2.
Si un radical está repetido varias veces, se indica con los prefijos di-, tri-,...
Si la amina lleva radicales diferentes, se nombran alfabéticamente.
Si la amina lleva radicales diferentes, se nombran alfabéticamente.
Regla 3.
Los sustituyentes unidos directamente al nitrógeno llevan el localizador N. Si en la molécula hay dos grupos amino sustituidos se emplea N,N'.
Regla 4.
Cuando la amina no es el grupo funcional pasa a nombrarse como amino-. La mayor parte de los grupos funcionales tienen prioridad sobre la amina (ácidos y derivados, carbonilos, alcoholes)
ALCOHOLES Y FENOLES
¿Qué son?
Los alcoholes son compuestos que tienen un grupo –OH (hidroxilo), como función unido a una cadena alifática. En el caso de los fenoles, son compuestos orgánicos que resultan de sustituir átomos de hidrogeno del grupo bencénico por el grupo hidroxilo (-OH), Son compuestos diferentes a los alcoholes a pesar de que poseen el grupo funcional hidroxilo, pero presentan propiedades físicas semejantes.
Formula general
Alcoholes: R-OH
Los fenoles: Estos tienen el mismo grupo funcional, pero unido a un anillo aromático Ar –OH: Donde Ar significa radical bencénico o grupo aromático
Características
Tanto alcoholes como fenoles, constituyen una gama amplia de sustancias de gran importancia a nivel industrial como materia prima para medicamentos, licores, polímeros como solventes polares y en la síntesis de otros compuestos orgánicos.
Clasificación:
Los alcoholes, al igual que los halogenuros de alquilo, se clasifican o dividen en primarios, secundarios y terciarios, según el número de grupos hidrocarbonados unidos al átomo de carbono al que va enlazado el grupo hidroxilo.
Los fenoles se clasifican según el número de OH presentes en el anillo bencénico: monofenoles, difenoles y trifenoles.
· Según la posición de los OH los difenoles se clasifican en Ortofenol diol, Metafenol diol y Parafenol diol.
¿Cómo se nombran?
Los alcoholes se nombran a través de la nomenclatura de IUPAC sustituyendo el sufijo -ano por -ol en el nombre del alcano progenitor, e identificando la posición del átomo del carbono al que se encuentra enlazado el grupo hidroxilo, siguientes las siguientes pautas:
1. Elegimos como cadena principal la de mayor longitud que contenga el grupo -OH.
2. Se numera la cadena principal para que el grupo -OH tome el localizador más bajo. El grupo hidroxilo tiene preferencia sobre cadenas carbonadas, halógenos, dobles y triples enlaces.
3. El nombre del alcohol se construye cambiando la terminación -o del alcano con igual número de carbonos por –ol
Para tener en cuenta:
· Cuando en la molécula hay grupos grupos funcionales de mayor prioridad, el alcohol pasa a ser un mero sustituyente y se llama hidroxi-. Son prioritarios frente a los alcoholes: ácidos carboxílicos, anhídridos, ésteres, haluros de alquilo, amidas, nitrilos, aldehídos y cetonas.
· El grupo -OH es prioritario frente a los alquenos y alquinos. La numeración otorga el localizador más bajo al -OH y el nombre de la molécula termina en -ol.
· Cuando el alcohol es la función principal, si existen dos o más grupos hidroxilo, se emplean los prefijos di, tri, etc. Dependiendo de la cantidad de –OH presentes
Los fenoles no siguen ninguna regla fija de nomenclatura, los más simples sin embargo, pueden ser nombrados utilizando el anillo aromático como cadena principal y los grupos ligados a él como radicales.
-Teniendo en cuenta la ubicación del –OH (Orto, meta, para)
Para nombrar los fenoles se utiliza, como en los alcoholes el sufijo -ol al nombre del hidrocarburo aromático. Los fenoles se nombran con mayor frecuencia como derivados del fenol. Los otros sustituyentes del anillo se localizan con un número o mediante los prefijos orto, meta, para.
· Cuando el grupo OH no es la función principal se utiliza el prefijo "hidroxi-" acompañado del nombre del hidrocarburo.
· El grupo hidroxilo también se nombra como sustituyente cuando se encuentra presente en la misma molécula un ácido carboxílico, un aldehído o alguna cetona, ya que tienen prioridad en la nomenclatura
· Si el benceno tiene varios substituyentes, diferentes del OH, enumeramos de forma que reciban los localizadores más bajos desde el grupo OH, y al ordenar se hace por orden alfabético. En caso de que haya varias opciones decidirá el orden de preferencia alfabético de los radicales.
2-etil-4,5-dimetilfenol
CETONAS
Las Cetonas se producen por oxidación leve de alcoholes secundarios.
El grupo funcional de las Cetonas se llama grupo carbonilo y es:
El carbonilo es el átomo de carbono unido a uno de oxígeno a través de un doble enlace. Las otras dos valencias se encuentran ocupadas por dos radicales de hidrocarburos que pueden ser cadenas carbonadas o anillos aromáticos.
Según la nomenclatura oficial, las cetonas se nombran agregando la terminación o sufijo “ona” al hidrocarburo de base. Como se vio en el ejemplo. Si tiene 3 carbonos deriva del propano, propanona. Si fuera lineal de 4 carbonos derivaría del butano, butanona, etc.
Ya a partir de 4 carbonos es necesario agregar un número que indicará el lugar donde se ubica el grupo funcional cetona (grupo carbonilo).
Por ejemplo:
Propiedades físicas:
Las cetonas hasta un tamaño de 10 carbonos son líquidas. Por encima de 10 carbonos son sólidos.
Las primeras tienen un olor particular agradable, las siguientes son de olor fuerte desagradable y las superiores son inodoras.
Las alifáticas son todas menos densas que el agua. La propanona presenta solubilidad en agua, las otras son poco solubles. Si son solubles en éter, cloroformo, etc…
Propiedades Químicas:
Reacciones de adición
Adición de Hidrógeno:
Al igual que los aldehídos, las cetonas pueden adicionar átomos de hidrógeno en presencia de catalizadores.
Adición de sulfito ácido de sodio:
Adición de ácido cianhídrico:
Oxidación: Los aldehídos se oxidan con facilidad. En presencia de un oxidante fuerte y calor, se rompe la cadena a la altura del grupo funcional y se forman dos moléculas de ácido.
Reacciones de sustitución:
Con halógenos dan reacciones de sustitución:
La Halogenación puede continuar hasta llegar al tricloro-1, 1,1-propanona.
Las cetonas como los aldehídos presentan un fenómeno que se denomina tautomería. Básicamente es una transformación intramolecular que experimentan solo algunas sustancias. En este caso se llama tautomería cetoenólica.
Condensación: Al igual que los aldehídos, las cetonas experimentan un proceso de condensación entre sus moléculas.
A continuación compararemos en el siguiente cuadro las reacciones de aldehídos y cetonas para establecer algunas diferencias.
Aldehídos
|
Cetonas
| |
Hidrogenación
|
Dan Alcoholes primarios
|
Dan Alcoholes secundarios
|
Oxidación
|
Dan ácidos de igual N° de C
|
Dan 2 ácidos
|
AgNO3 amoniacal
|
Reducen la plata
|
No reducen
|
Reactivo Fehling
|
Reducen al Cu (II)
|
No reducen
|
Reactivo de Schiff
|
Positivo
|
Negativo
|
Quinonas:
Son un tipo especial de cetonas que derivan del benceno. Dos átomos de hidrógeno son reemplazados por dos de oxígeno. En el anillo quedan dos dobles enlaces.
¿Cómo se nombra?
- Se pueden nombrar de dos formas: anteponiendo a la palabra "cetona" el nombre de los dos radicales unidos al grupo carbonilo
- o, más habitualmente, como derivado del hidrocarburo por substitución de un CH2 por un CO, con la terminación "-ona", y su correspondinte número localizador, siempre el menor posible y prioritario ante dobles o triples enlaces.
3-pentanona o penta-3-ona (Normas IUPAC 1993)
|
- Cuando la función cetona no es la función principal, el grupo carbonilo
- se nombra como "oxo".
ácido 4-oxopentanoico
|
Los aldehídos son compuestos orgánicos que resultan de la oxidación suave y la deshidratación de los alcoholes primarios, estos son caracterizados por poseer el grupo funcional conocido como grupo carbonilo el cual está formado por un carbono y un oxígeno unidos por enlace múltiple (C=O), cuando encontremos el grupo carbonilo en un extremo de la cadena, podemos afirmar que se trata de aldehídos, de esta forma podremos diferenciarlos de las cetonas. En este caso el carbono estará unido a un átomo de hidrógeno y a una grupo alquilo o arilo (-CHO), como lo podemos observar en la siguiente ilustración.
Caracteristicas
· Los aldehídos que se encuentran en estado líquido es debido a su estructura, en la cual tienen de 2 a 12 Carbonos y al sobre pasar los 12 carbonos se observa en estado solido
· Son solubles en agua y en otros solventes polares
· En la industria se utilizan como germicidas, aislantes, como saborizantes, en la fabricación de resinas, pinturas, antisépticos, etc.
¿Cómo se nombran?
NITRILOS
¿Qué son?
Se caracterizan por tener el grupo funcional "ciano" -CN, por lo que a veces también se les denomina cianuros de alquilo.
Propiedades químicas
· El olor de los nitrilos recuerda al del cianuro de hidrógeno y son moderadamente tóxicos.
· Los nitrilos, aunque no contienen el enlace C=O, se consideran a veces como derivados funcionales de los ácidos carboxílicos porque en la reacción de hidrólisis (en medios ácidos o básicos) se transforman en ácidos carboxílicos y sales de amonio.
R - CN + 2H2 --> R - COOH + NH3
· Los nitrilos adicionan hidrógeno en presencia de un catalizador produciendo aminas = hidrogenación
CH3 - CN + 2H2 --> CH3 - CH2 - NH2
· Sustitución electrofílica:
Permite aumentar en un átomo de carbono la cadena de un compuesto.
Propiedades físicas
Los primeros términos de la serie son líquidos, los superiores (más de 14 carbonos) son sólidos. Los nitrilos de bajo peso molecular son solubles en el agua. Los nitrilos de bajo peso molecular son líquidos a temperatura ambiental (excepto el HCN). Son más densos que el agua. La temperatura de ebullición de los nitrilos es generalmente superior a los ácidos correspondientes.
¿Cómo se nombran?
A) añadir el sufijo –nitrilo al nombre del hidrocarburo de igual número de átomos de carbono;
B) considerarlo como un derivado del ácido cianhídrico, HCN;
C) nombrarlo como derivado del ácido RCOOH, relacionando RCOOH con RCN, en el caso de que dicho ácido tenga nombre trivial aceptado.
Usos:
Se utiliza en la producción de colorantes.
Sirve para la producción de guantes de látex, para la industria química y farmacéutica. Se utiliza para la producción de esmaltes y pinturas. Productos de limpieza para uso industrial. |
Las amidas son derivados funcionales de los ácidos.
Am Una amida es un compuesto orgánico cuyo grupo funcional es del tipo RCONR'R'', siendo CO un carbonilo, N un átomo de nitrógeno, y R, R'
Am Una amida es un compuesto orgánico cuyo grupo funcional es del tipo RCONR'R'', siendo CO un carbonilo, N un átomo de nitrógeno, y R, R'
Propiedades físicas:
La primera es gaseosa, hasta la de 11 carbonos son líquidas, luego sólidas.
Como siempre, el punto de ebullición aumenta con la cantidad de carbonos.
Con respecto a su solubilidad, las primeras son muy solubles en agua, luego va disminuyendo con la cantidad de átomos de carbono.
Propiedades químicas:
Combustión: Las aminas a diferencia del amoníaco arden en presencia de oxígeno por tener átomos de carbono.
Poseen un leve carácter ácido en solución acuosa.
Formación de sales:
Las aminas al ser de carácter básico, son consideradas bases orgánicas. Por lo tanto pueden reaccionar con ácidos para formar sales.
¿Cómo se nombran?
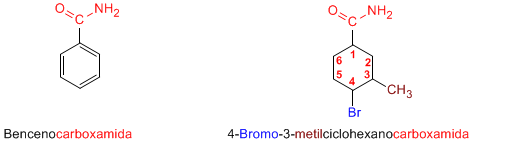
Las amidas se nombran como derivados de ácidos carboxílicos sustituyendo la terminación -oico del ácido por -amida.
Las amidas son grupos prioritarios frente a aminas, alcoholes, cetonas, aldehídos y nitrilos.
Las amidas actúan como sustituyentes cuando en la molécula hay grupos prioritarios, en este caso, preceden el nombre de la cadena principal y se nombran como carbamoíl-.......
Cuando el grupo amida va unido a un ciclo, se nombra el ciclo como cadena principal y se emplea la terminación -carboxamida para nombrar la amida.
Usos:
Es muy usada en la industria de los colorantes, como el caso del azul y negro de anilina. También ha tenido utilidad en la preparación de fármacos y en la industria fotográfica.
ÉSTERES
Son derivados de ácidos carboxílicos. Se obtienen por reacción de un ácido con alcoholes.
Propiedades
Los ésteres dan sabor y olor a muchas frutas y son los constituyentes mayoritarios de las ceras animales y vegetales.
Propiedades Químicas:
Hidrólisis ácida:
Ante el calor, se descomponen regenerando el alcohol y el ácido correspondiente. Se usa un exceso de agua para inclinar esta vez la reacción hacia la derecha. Como se menciono es la inversa de la esterificación.
Hidrólisis en medio alcalino:
En este caso se usan hidróxidos fuertes para atacar al éster, y de esta manera regenerar el alcohol. Y se forma la sal del ácido orgánico.
¿Cómo se nombran?
|
Los ésteres proceden de condensar ácidos con alcoholes y se nombran como sales del ácido del que provienen. La nomenclatura IUPAC cambia la terminación -oico del ácido por -oato, terminando con el nombre del grupo alquilo unido al oxígeno.
Los esteres son grupos prioritarios frente a aminas, alcoholes, cetonas, aldehídos, nitrilos, amidas y haluros de alcanoilo. Estos grupos se nombran como sustituyentes siendo el éster el grupo funcional.
Ácidos carboxílicos y anhídridos tienen prioridad sobre los ésteres, que pasan a nombrarse como sustituyentes (alcoxicarbonil......)
Cuando el grupo éster va unido a un ciclo, se nombra el ciclo como cadena principal y se emplea la terminación -carboxilato de alquilo para nombrar el éster.
Usos:
La mejor aplicación es utilizarlo en esencias para dulces y bebidas ya que se hallan de forma natural en las frutas. Otros para preparar perfumes. Otros como antisépticos, como el cloruro de etilo.
ÁCIDOS CARBOXILICOS
Ácidos carboxílicos. Constituyen un grupo de compuestos químicos que se caracterizan por poseer un grupo funcional llamado grupo carboxilo o grupo carboxi (–COOH); produciéndose este cuando sobre un mismo carbono coincide un grupo hidroxilo (-OH) y carbonilo (C=O). Se puede representar como COOH o CO2H.
Generalidades
El grupo carboxilo, -C00H, es la unidad funcional característica de los ácidos carboxílicos, los cuales pueden pertenecer a la serie alifática, RCOOH, aromática, ArCOOH, o heterocíclica. Esta clase de compuestos incluye también a los ácidos dicarboxílicos y policarboxílicos (dos o más grupos -C00H en la molécula), así como a los ácidos carboxílicos que poseen también otros grupos funcionales. Una gran variedad de ácidos carboxílicos son productos naturales, y este tipo de compuestos cumplen innumerables funciones tanto en la naturaleza como en la industria.
El ácido acético, el componente ácido del vinagre, es un ácido carboxílico de gran importancia industrial, el ácido cítrico, el que da su sabor agrio a los frutos cítricos, es un intermedio importante del metabolismo de los hidratos de carbono, el ácido cólico se encuentra en la bilis de los animales, y el ácido gálico, presente en las agallas y otras fuentes vegetales. Muchos derivados de los ácidos carboxílicos, en particular los ésteres y las amidas se encuentran ampliamente difundidos en la naturaleza y tienen gran importancia e interés
¿Cómo se nombran?
Se nombran anteponiendo la palabra "ácido" al nombre del hidrocarburo del que proceden y con la terminación "-oico".
ácido etanoico
Son numerosos los ácidos dicarboxílicos, que se nombran con la terminación "-dioico”
Ácido propanodioico
Con frecuencia se sigue utilizando el nombre tradicional, aceptado por la IUPAC, para muchos de ellos, fíjate en los ejemplos.
Cuando los grupos carboxílicos se encuentran en las cadenas laterales, se nombran utilizando el prefijo "carboxi-" y con un número localizador de esa función. Aunque en el caso de que haya muchos grupos ácidos también se puede nombrar el compuesto posponiendo la palabra "tricarboxílico", "tetracarboxílico", etc., al hidrocarburo del que proceden.
|
|
|
|
Fuentes:
Fenoles – Nomenclatura y ejemplos | La Guía de Química http://quimica.laguia2000.com/conceptos-basicos/fenoles-nomenclatura-y-ejemplos#ixzz4AHVnlzxA































































































No hay comentarios:
Publicar un comentario